1. Die verwendeten Proben-Metalle
Die verwendeten Proben-Metalle wurden speziell für die Untersuchung der Metall-Adsorption und der Oberflächenlegierungsbildung ausgesucht.
Rhenium (Re) bietet als Substratmaterial besondere Vorteile, wie die hohe thermische und mechanische Stabilität. Es eignet sich gut zum Probenaufbau und läßt sich relativ leicht reinigen. Es verhält sich zu den verwendeten Edelmetallen (Kupfer, Silber, Gold) ziemlich inert, mit Palladium könnte es jedoch legieren. Speziell die verwendete atomar sehr glatte (0001)-Oberfläche läßt erwarten, daß die Wechselwirkungen der zu untersuchenden Systeme nahezu vollständig beschreibbar sind.
Kupfer (Cu), Silber (Ag) und Gold (Au) wurden als Adsorbatmaterialien ausgewählt, weil sie leicht zu präparieren sind und mit dem Substrat keine Legierungen bilden. (Der historisch im Zusammenhang mit der Wechselwirkung von Gasen mit Oberflächen entstandene Begriff der Adsorption soll hier auch für die Metall-auf-Metall-Systeme verwendet werden.) Die drei Münzmetalle besitzen zum Teil vergleichbare Eigenschaften, so daß sich synergetisch zusätzliche Erkenntnisse ergeben sollten. Sie bilden untereinander binäre Volumenlegierungen, mit der Ausnahme des Cu-Ag-Systems. Auch hier werden durch vergleichende Untersuchungen zusätzliche Erkenntnisse erwartet. Palladium (Pd) soll als Beispiel für ein mit dem Substrat legierendes Material untersucht werden. Auch Pd-Filme sind relativ leicht zu präparieren.
Wichtig ist zusätzlich die Tatsache, daß auf einen erheblichen Wissensstand aus der Literatur sowie ein großes know how im Umgang mit den verwendeten Materialien [Sch98/d, Vol99/d, Kur99/d, Wag97/d] zurückgegriffen werden kann.
Im folgenden werden zunächst die verwendeten Metalle beschrieben und hinsichtlich ihres Einsatzes als Adsorbate verglichen. Da auch speziell die Legierungsbildung in dieser Arbeit eine große Rolle spielt, wird daraufhin auf eventuelle Volumenlegierungen eingegangen. Im Abschluß wird die verwendete (0001)-Oberfläche beschrieben.
1.1 Kupfer
Kupfer ist ein rötlich schimmerndes, zähes Metall, das sich durch seine hohe Leitfähigkeit für Wärme und Elektrizität auszeichnet. Sein Name leitet sich vom lateinischen Wort "cuprum" ab, was die Insel Zypern beschreibt. (Die Bezeichnung der englischen Polizisten "cops" ist wegen der Kupfernieten ihrer Uniformen von "copper" abgeleitet.)
Kupfer ist seit prähistorischen Zeiten bekannt. Erste geschichtliche Berichte aus dem Gebiet des heutigen Irak gehen auf ca. 9000 v. Chr. zurück. 5000 bis 4000 v. Chr. wurde es in Nordamerika erstmals verhüttet. Ein Grund für seine so frühe Nutzung liegt in seiner leichten Bearbeitbarkeit. Um die damit verbundene relativ geringe Härte zu erhöhen, wurden bald Kupferlegierungen, wie z. B. Bronze (Cu+Zn) oder Messing (Cu+Sn) verwendet.
Kupfer kommt zu 68 ppm in der Erdkruste und zu 3 x 10-3 ppm im Wasser der Ozeane vor. Dabei liegt es gediegen oder hauptsächlich in Form seiner Sulfide (Kupferkies, Buntkupferkies, Kupferglanz) oder Oxide (Rotkupfererz, Malachit, Kupferlasur) vor.
Die hauptsächlichen Verwendungen von Kupfer sind:
- in der elektrotechnischen / elektronischen Industrie (insbesondere als Cu-Draht),
- bei der Galvanisierung,
- als Münzmetall und allgemein als Legierungsmaterial (Bronze, Messing, Neusilber,...),
- in seinen Verbindungen in der Analyse (z. B. Fehling‘sche Lösung), bei der Schädlingsbekämpfung und
- bei der Farbherstellung.
Die Elektronenkonfiguration des Kupfers lautet [Ar]3d104s1, sein Termsymbol 2S1/2. Es besitzt also eine gefüllte d- und eine halb gefüllte s-Schale als relativ stabile Konfiguration. Es hat die Ordnungszahl 29 und eine molare Masse von 63,546 g/mol bei einer Isotopenverteilung von [63/65] = 69%/31%. Im Periodensystem der Elemente befindet es sich in der 11. Gruppe (1. Nebengruppe) und der 4. Periode.
Kupfer kristallisiert in der kubisch dichtesten Kugelpackung Fm-3m (ccp/fcc) mit dem Gitterparameter a = 361,49 pm.
1.2 Silber
Silber ist ein weiß glänzendes, weiches und duktiles Edelmetall, das von allen Elemente den höchsten elektrischen Leitwert und die höchste Reflektivität für Licht besitzt. Der Name "Silber" leitet sich vom angelsächsischen "siolfur" ab, das Symbol "Ag" stammt vom lateinischen „Argentum".
Silber ist seit der Antike bekannt. Aus Funden von Schlackeresten im Ägäischen Meer schließt man auf die erstmalige Trennung von Silber und Blei um 3000 v. Chr..
Silber kommt zu 0,08 ppm in der Erdkruste und zu 1 x 10-4 ppm im Wasser der Ozeane vor. Man findet es gediegen oder gewinnt es aus seinen sulfidischen Erzen (Silberglanz, Pyrargyrit, Proustit, Stephanit, Arsen- und Antimonfahlerz, Silberantimon- und Kupfersilberglanz).
Silber hat ein breites Spektrum von Anwendungen:
- elektrische Kontakte, Silberfarbe zur Produktion elektronischer Schaltkreise,
- Herstellung von Silber-Cadmium-Batterien,
- in Form von Legierungen:
- in der Schmuckindustrie,
- in der Dentaltechnik,
- als Löt- und Hartlötmetall,
- als Münzmetall,
- in Form seiner Verbindungen:
- in der Fotografie (Nitrat, Bromid),
- zur Anregung des Regens (Iodid).
Silber befindet sich im Periodensystem der Elemente in der 11. Gruppe (1. Nebengruppe) und der 5. Periode. Seine Ordnungszahl ist 47, seine molare Masse beträgt 107,8682 g/mol. Es besteht hauptsächlich aus zwei Isotopen, [107/109] = 52%/48%. Silber besitzt eine gefüllte 4d-Schale und eine halb gefüllte 5s-Schale und ist deshalb ebenfalls relativ stabil (Elektronenkonfiguration: [Kr]4d105s1, Termsymbol 2S1/2).
Auch Silber kristallisiert in der kubisch dichtesten Kugelpackung Fm-3m (ccp/fcc) und hat den Gitterparameter a = 408,53 pm.
1.3 Gold
Das "Königsmetall" Gold ist das duktilste und dehnbarste Metall. (Aus einem Würfel von 1 cm³ läßt sich eine quadratische Goldfolie mit einer Kantenlänge von 4,8 m herstellen.) Es ist (in kompakter Form) gelbglänzend, was auf die relativistisch bedingte Orbitalkontraktion vor allem der s-Orbitale und der damit verbundenen Verringerung des 5d-6s-Abstandes zurückgeführt wird, der so durch sichtbares Licht angeregt werden kann. Sein Name leitet sich vom angelsächsischen "gold" ab, sein Elementensymbol stammt vom lateinischen "Aurum".
3600 v. Chr. wurde Gold in den Gesetzbüchern des ägyptischen Königs Menes erwähnt, ebenso in den ältesten Teilen der Bibel und bei Homer. Die ersten Goldmünzen gab es 650 v. Chr. im Orient.
Gold kommt zu 3,1 x 10-3 ppm in der Erdkruste und zu 5 x 10-5 ppm im Wasser der Ozeane vor. Es liegt hauptsächlich gediegen eingesprengt in Quarz in der Natur vor (3/4 der Weltproduktion stammen aus Südafrika). Man findet aber auch (zumeist telluride) Erze (Schrifterz, Blättertellur, Petzit, Calaverit).
In vielen Staaten ist es der Standard des Währungssystems. Gold wird vorwiegend in der Schmuckherstellung und als Münzmetall verwendet und außerdem:
- als Kontakt in der Elektronik,
- zur Oberflächenveredelung,
- in der Zahntechnik und bei der Behandlung von Arthritis und Krebs (198Au),
- in der Fotografie,
- als Katalysator.
Gold ist ein Element der 11. Gruppe (1. Nebengruppe) und 6. Periode. Seine Ordnungszahl ist 79, seine molare Masse beträgt 196,96655 g/mol. Es besteht hauptsächlich aus einem Isotop und besitzt eine gefüllte 5d-Schale und eine halb gefüllte 6s-Schale. Dieses Metall ist ebenfalls relativ stabil (Elektronenkonfiguration: [Xe]5d106s1 , Termsymbol 2S1/2 ).
Wie Kupfer und Silber kristallisiert auch Gold in der kubisch dichtesten Kugelpackung Fm-3m (ccp/fcc). Es hat den Gitterparameter a = 407,82 pm.
1.4 Palladium
Die herausragende Eigenschaft des weiß glänzenden Palladiums ist, bei Raumtemperatur das 900-fache seines Volumens an Wasserstoff zu absorbieren. Bei erhöhten Temperaturen diffundiert Wasserstoff hindurch, was zur Reinigung dieses Gases angewendet wird. Benannt wurde es nach dem Asteroiden Pallas, der zur gleichen Zeit entdeckt wurde, sowie nach der griechischen Göttin der Weisheit.
Palladium wurde 1803 von William Hyde Wollaston in England entdeckt. Er extrahierte es aus Platinerz.
Es kommt zu 6,3 x 10-3 ppm in der Erdkruste hauptsächlich gediegen, aber auch vergesellschaftet mit Kupfer, Nickel oder anderen Platinmetallen in deren Erzen vor.
Fein verteiltes Palladium kommt als Katalysator bei der (De-) Hydrogeneration zum Einsatz. Weitere Anwendungen sind:
- in der Schmuckherstellung (Weißgold),
- in der Zahntechnik, für feinmechanische und chirurgische Geräte,
- als Kontakt in der Elektronik.
Das Termsymbol des Palladiums ist 1S0, seine Elektronenkonfiguration [Kr]4d10, womit es eine gefüllte 4d-Schale besitzt und recht stabil ist. Im PSE ist es in der 10. Gruppe (8. Nebengruppe) und 4. Periode zu finden. Es hat die Ordnungszahl 46 und eine molare Masse von 106,42 g/mol. Es besteht hauptsächlich aus fünf Isotopen: 104 (11%), 105 (22%), 106 (27%), 108 (26%), 110 (12%).
Palladium kristallisiert in der kubisch dichtesten Kugelpackung Fm-3m (ccp/fcc). Es hat den Gitterparameter a = 389,07 pm.
1.5 Rhenium
Das weiß-grau glänzende Rhenium hat die viertgrößte Dichte und den dritthöchsten Schmelzpunkt aller Elemente. Auf Grund seiner extremen Eigenschaften ist es ein sehr begehrtes, allerdings auch sehr seltenes Metall. Bei 1,7 K wird Re supraleitend.
W. Noddak, I. Tacke und O. Berg entdeckten das Rhenium 1929 nach gezielter Suche durch Röntgenspektroskopie und benannten es nach dem Rhein.
Mit seinem Vorkommen von 2,6 x 10-3 ppm in der Erdkruste und zu 1 x 10-6 ppm im Wasser der Ozeane ist es, wie o. a., sehr selten. Rhenium kommt nur in den Erzen anderer Elemente in Spuren vor, wie z. B. im Molybdänglanz (0,1 ppm bis 1 ppm), in Columbit, Gadolinit, Tantalit, in Platinerzen sowie in den Abfallprodukten der Kupferverhüttung (5 ppm).
Die Anwendungen des Rheniums basieren hauptsächlich auf seiner Temperaturbeständigkeit und Härte:
- Glühkathoden in der Vakuumtechnik,
- Glühdrähte für Fotolampen,
- Hochtemperatur-Thermoelemente mit hoher Thermokraft,
- Re/Mo-Legierungen als Supraleiter bei 10 K,
- abrieb- und lichtbogenfestes elektrisches Kontaktmaterial,
- Katalysator für Hydrogenierungs- und Hydrocrackingprozesse sowie Alken-Disproportionierungsreaktionen.
Das Termsymbol des Rheniums ist 6S5/2, seine Elektronenkonfiguration [Xe]4f145d56s2. Im PSE steht es in der 7. Gruppe (5. Nebengruppe) und 6. Periode. Es hat die Ordnungszahl 75 und eine molare Masse von 186,207 g/mol. Es besteht hauptsächlich aus zwei Isotopen, [185/187] = 37%/63%.
Rhenium kristallisiert in der hexagonal dichtesten Kugelpackung P63/mmc (hcp). Es hat die Gitterparameter a = 276,1 pm und c = 445,6 pm.
1.6 Wichtige Daten der verwendeten Metalle
Nachfolgend sind, die wichtigsten Parameter der verwendeten Metalle angeführt:
|
Größe |
Einheit |
Re |
Cu |
Ag |
Au |
Pd |
|
|
Molmasse |
g/mol |
186,21 |
63,55 |
107,87 |
196,97 |
106,42 |
|
|
Schmelzpunkt |
K |
3495 |
1357,77 |
1234,93 |
1337,33 |
1828,05 |
|
|
Siedepunkt |
K |
5869 |
2840[1] |
2436[1] |
3130[1] |
3236 |
|
|
Dichte |
g/cm³ |
21,0 |
8,96 |
10,5 |
19,3 |
12,0 |
|
|
Struktur |
hcp |
fcc |
fcc |
fcc |
fcc |
||
|
Atomabstand |
pm |
274,1 |
255,6 |
288,9 |
288,4 |
275,1 |
|
|
Oberflächendichte |
1015/cm² |
1,54 |
1,77 |
1,38 |
1,39 |
1,53 |
|
|
Oberflächenenergie[2] |
berechnet |
J/m² |
4,21 |
1,95 |
1,17 |
1,28 |
1,95 |
|
gemessen |
3,6 |
1,82 |
1,25 |
1,5 |
2,05 |
||
|
Pauling-Elektronegativität |
1,9 |
1,9 |
1,93 |
2,54 |
2,2 |
||
|
1. Ionisierungsenergie |
eV |
7,87 |
7,72 |
7,57 |
9,22 |
8,33 |
|
|
Elektronenaffinität |
eV |
0,15 |
1,23 |
1,30 |
1,72 |
0,56 |
|
|
Fermienergie[3] |
eV |
-4,7 |
-4,4 |
-4,3 |
-4,3 |
-5,3 |
|
|
Elektronen- Austrittsarbeit |
eV |
5,4[4]; 4,8[5]; 4,96[6] |
4,7[7]; 4,9[8] |
4,3[7]; 4,74[9] |
5,45[7]; 5,31[9] |
5,2[7]; 5,55[9] |
|
|
Bindungsenergie |
X2[10] |
kJ/mol |
773,7 |
336,3 |
284,2 |
367,1 |
374,8 |
|
Kristall |
- |
176,5 |
163,0 |
224,7 |
75,0 |
||
|
Sublimationsenergie |
Cluster |
kJ/mol |
705 |
300 |
255 |
330 |
380 |
|
Atom |
770; 770,4[11] |
337,4; 341,4[12] |
284,9; 275,1[12] |
366; 379,3[12] |
378; 377,4[12] |
||
Alle Daten, die sich auf Oberflächen beziehen, entsprechen den dichtest gepackten Lagen des korrespondierenden Gitters, also (0001) für hcp und (111) für fcc (ccp). Die meisten Werte sind [www_01] entnommen, außer [1] - [www_05], [2] - [VRS98/1], [3] - [Nor84/1], [4] - [YAW00/1], [5] - [BEN73/b], [6] - [Wil66/1], [7] - [Moe68/b], [8] - [CES80/1], [9] - [Par88/1], [10] - [Lid74/b], [11] - [GoE99/1], [12] - [LPS00/1].
1.7 X-Re-Volumenlegierungen (X = Cu, Ag, Au, Pd)
Versuche, Volumenlegierungen aus Kupfer und Rhenium durch Vermischen der Substanzen und Erhitzen (bis 2175°C) herzustellen, schlugen fehl [HaA58/b, HoS54/1]. Durch elektrochemische Abscheidung ist es jedoch möglich, Legierungsphasen aus Kupfer und Rhenium herzustellen. Diese konnten von Schrebler et al. (10% Re) [SMC01/1] und Nikitina et al. (30% Cu) [NSV66/1] elektrolytisch aus Perrhenat- und Kupferionen erhalten werden.
Rhenium ist in flüssigem und festem Silber bzw. Gold unlöslich. Binäre Volumenlegierungen sind nicht bekannt [HaA58/b, HoS54/1].
Über das Mischungsverhalten von Palladium und Rhenium ist ebenfalls relativ wenig bekannt. Vidosova gelang es, durch dreitägiges Erhitzen einer Pd-Re-Mischung auf 1000°C ein Einphasengebiet des Systems für bis zu 7,4% Re zu detektieren sowie ein Zweiphasengebiet ab 20,4% Re. [HaA58/b, Vid54/1].
1.8 Ag-X- Volumenlegierungen (X = Cu, Au)
Zur Ausbildung von Mischkristallen sind sowohl strukturelle als auch elektronische Übereinstimmungen der Legierungspartner erforderlich. Als besonders günstig erweist es sich, wenn beide Metalle im selben Gittertyp kristallisieren. Dies ist sowohl für Kupfer und Silber als auch für Gold gegeben. Alle drei Metalle bilden kubisch-flächenzentrierte Gitter (fcc) aus.
Eine weitere strukturbestimmende Größe ist der Unterschied der Gitterkonstanten, der misfit f, s.
|
f [%] |
Phasendiagramm |
Bedeutung |
|
0 ... 6 |
spinodial |
unbegrenzt mischbar |
|
6 ... 8 |
azeotrop |
unbegrenzt mischbar, bei bestimmten Mischungsverhältnis ist der Schmelzpunkt geringer als in den Reinstoffen |
|
8 ... 15 |
eutektisch |
begrenzt mischbar, die kleinere Komponente ist bis zu 40 % in der größeren löslich, die größere in der kleineren bis zu 5 % |
|
< 15 |
eutektisch |
nicht mischbar |
Der misfit des Systems Ag+Cu beträgt 13 %, der des Systems Ag+Au 0,1 %. Aus
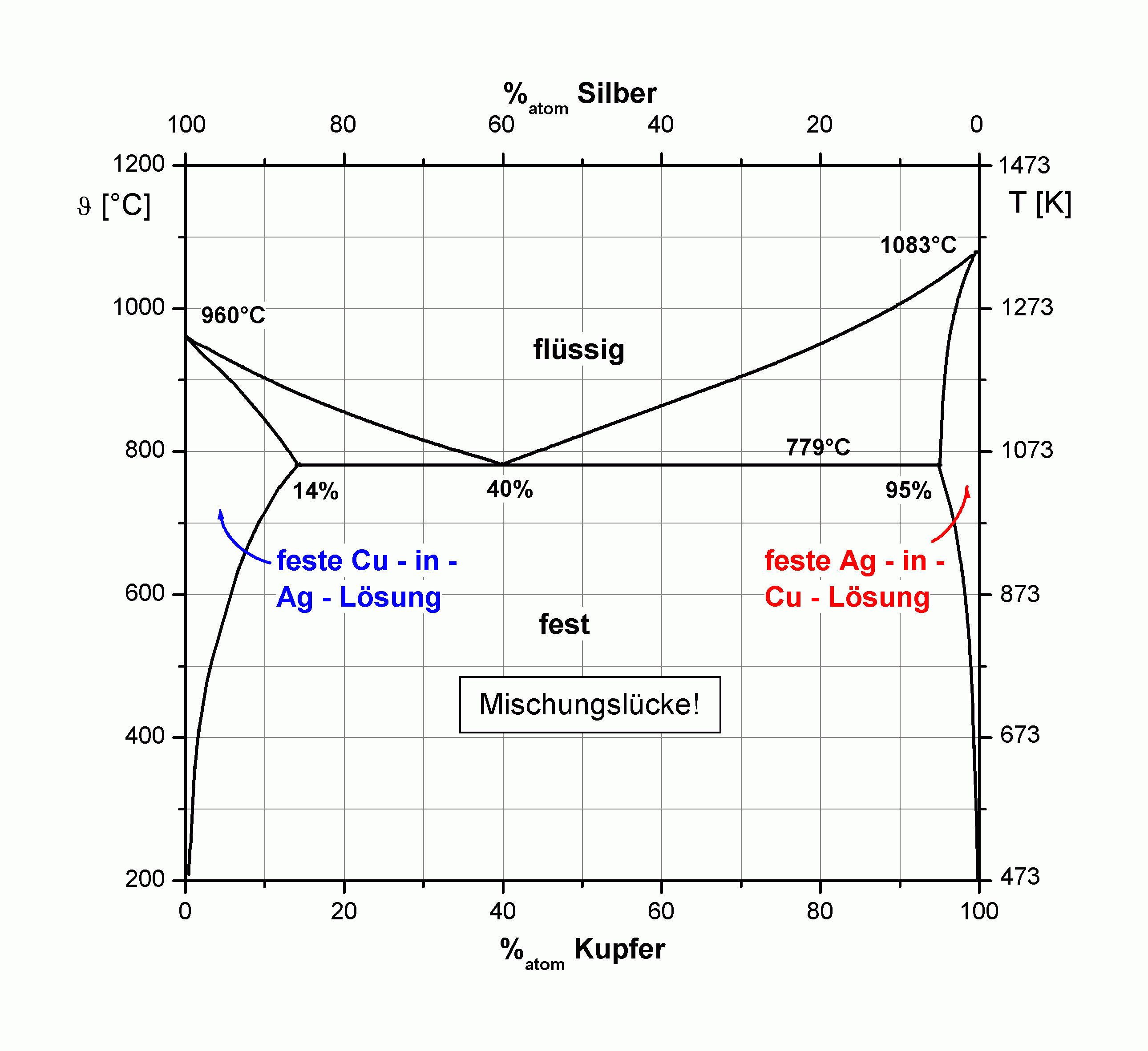
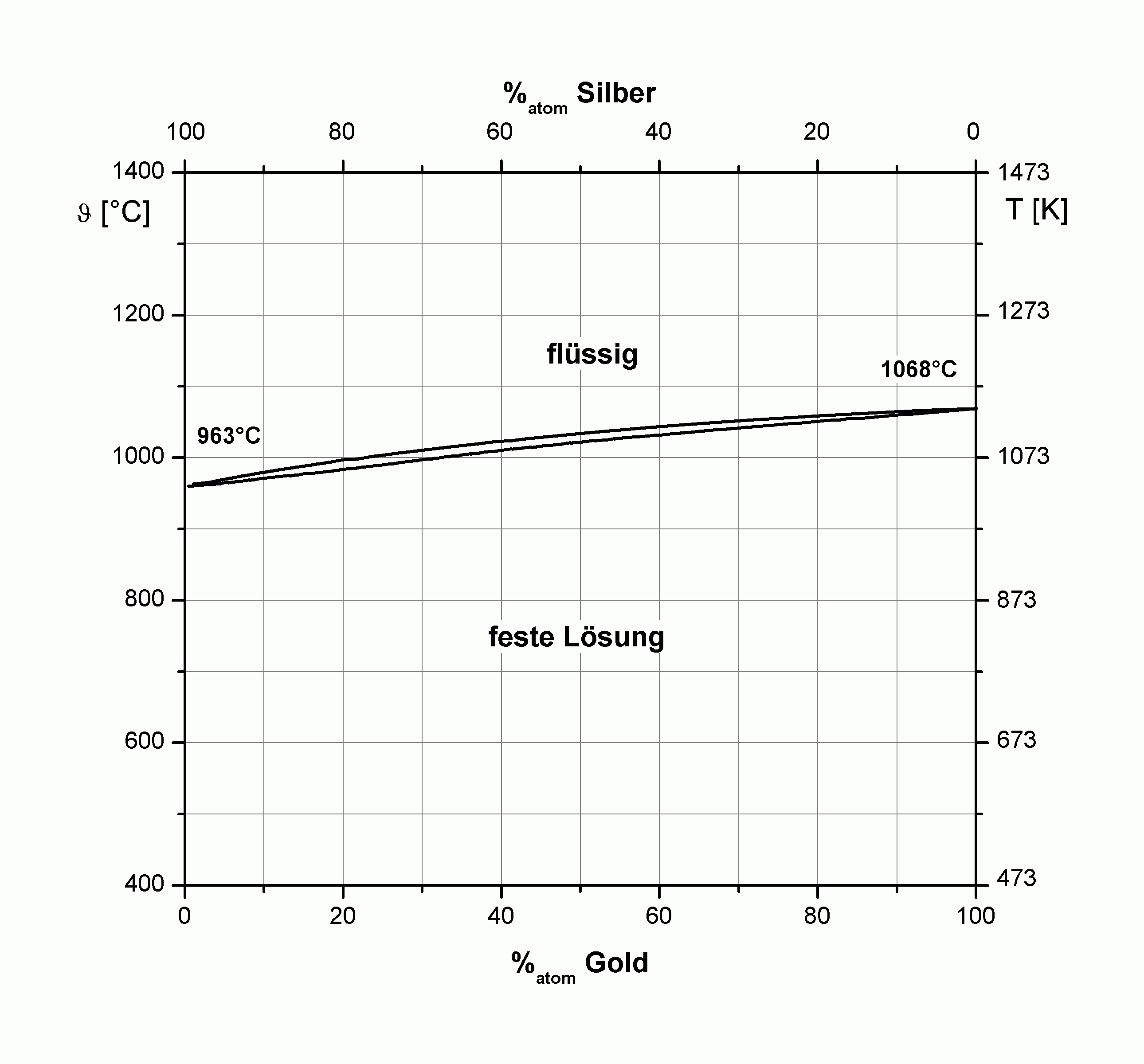
| |
| Abbildung A1 Phasendiagramme der Volumensysteme Ag-Cu (li.) und Ag-Au (re.) nach [HaA58/b]. |
|
Im Phasendiagramm des Systems Ag+Cu sind drei Einphasengebiete zu erkennen, nämlich das der flüssigen Lösung, sowie der festen silberreichen (bis zu 14 % Cu) und der festen kupferreichen (bis zu 5 % Ag) Lösung (vgl. Tabelle!). Diese drei Gebiete berühren sich im Eutektikum bei 40 % Cu und 1056 K [HaA58/b] und werden ansonsten durch drei Zweiphasengebiete voneinander getrennt. Die von Fitzner et al. [FGW99/1] angegebene Mischungsenthalpie bei 1375 K ist für das System Cu+Ag positiv (+3,4 kJ/mol), hingegen für die Systeme Cu+Au sowie Ag+Au negativ (-7,0 kJ/mol, bzw. -4,3 kJ/mol).
Das System Au+Cu weist mit 12,8 % einen misfit auf, der mit dem von Ag+Cu vergleichbar ist. Trotzdem zeigt sich ein unterschiedliches Mischungsverhalten derart, daß es bei Au+Cu zur Ausbildung einer Reihe geordneter Legierungsphasen (Cu3Au, CuAu, Au3Cu) und damit unbegrenzter Mischbarkeit kommt. Offenbar ist die Ausbildung geordneter Legierungsphasen eine Möglichkeit, die Mischungslücke begrenzt mischbarer Systeme zu unterdrücken.
Die bisher angestellten Überlegungen basieren auf dem Hartkugelmodell, d. h., elektronische Wechselwirkungen wurden nicht berücksichtigt. Auf Grund dessen wird die Forderung aufgestellt, daß beide Legierungspartner vergleichbare Elektronegativitäten haben sollten. Dies ist zumindest für das System Cu/Ag gegeben (Cu: 1,90; Ag: 1,93; Au: 2,54).
Beim System Silber/Gold kommt es zur Ladungskompensation, wobei Au Elektronendichte aus seinem d-Band an das Ag abgibt und Elektronendichte aus dem s-Band des Ag erhält, wie Watson et al. durch XPS-Messungen zeigten [WHP71/1].
1.9 Niedrig indizierte Metalloberflächen
Niedrig indizierte Metalloberflächen (und allgemein Einkristalle) werden in der Wissenschaft genutzt, um ein nach Möglichkeit einfaches und leicht zu beschreibendes System zur Untersuchung von Oberflächen-Wechselwirkungen zu schaffen. Sie stellen ein ideales Modell dar, in dem bestimmte Zusammenhänge besonders leicht zu durchschauen sind.
Zwar sind reale Probenkristalle mit einer solchen definierten Oberfläche durch das Auftreten von Defekten gekennzeichnet, doch gelingt es heutzutage, diese so gering zu halten, daß die Untersuchungen und Ergebnisse dadurch nicht oder nur sehr gering beeinflußt werden.
Die einfachsten oder fast "idealen" Oberflächen stellen die dicht gepackten Oberflächen mit tetra- oder hexagonaler Symmetrie dar. Aber auch spezielle Oberflächengeometrien mit Gräben oder verschiedene Microfacetten können die Grundlage für interessante Untersuchungssysteme sein.
1.9.1 Dicht gepackte, glatte Oberflächen
Möglichst glatte Substratoberflächen, die von verschiedenen Kristallgittertypen gebildet werden können, werden zur Untersuchung von Systemen genutzt, bei denen die Wechselwirkung zwischen Film und Unterlage möglichst gering sein soll. Es ist dabei u. U. möglich, für bestimmte Betrachtungen eine Adsorbatlage als von der Unterlage abgekoppelt anzusehen.
Sowohl hcp- als auch fcc-Kristalle besitzen Oberflächen mit der hexagonal dichtesten Kugelpackung, (0001) bzw. (111). Bei fcc-Kristallen kann zusätzlich die kubisch dichte (100)-Oberfläche auftreten. Bei bcc-Kristallen wird für Untersuchungen auf einer glatten Oberfläche oft die (110)-Ebene gewählt. In der Tabelle sind für die drei o. a. Substratgitter die Geometrien und Größen der primitiven Elementarzellen inklusive des Flächeninhalts A [amu] angeführt:
|
Gittertyp |
Fläche |
Geometrie und Raumerfüllung [
|
|
hcp |
(0001) |
|
|
fcc |
(111) |
|
|
(100) |
|
|
|
bcc |
(110) |
|
Die hcp(
1.9.2 Die hcp-(0001)- Oberfläche des Re
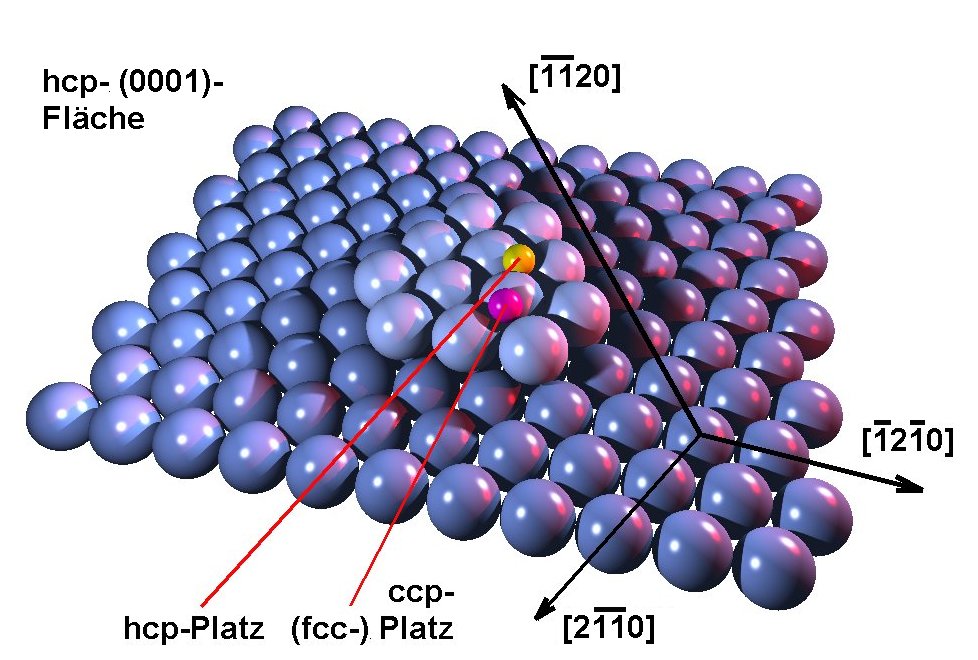
Die (0001)-Oberfläche des hcp-Kristalls repräsentiert die dichteste Kugelpackung und hat daher die größtmögliche Oberflächendichte. Sie besitzt eine sechszählige Symmetrie.
| |
| Abbildung A2 Lage der Richtungsvektoren und mögliche Adsorptionsplätze auf der hcp-(0001)-Fläche |
|
Gleichzeitig sind zwei mögliche dreifach koordinierte Adsorptionsplätze angegeben; gelb ein möglicher hcp- und violett ein fcc-"Muldenplatz". (Diese unterscheiden sich in der zweiten Substratlage, wo sich beim hcp-Platz (Stapelfolge ABAB) ein Substratatom befindet, hingegen beim fcc-Platz (Stapelfolge ABCA) nicht. Zusätzlich gibt es noch zwei weitere ausgezeichnete Adsorptionsplätze, nämlich der zweifach koordinierte "Brückenplatz" (zwischen zwei Atomen) und der einfach koordinierte "on top"-Platz (genau auf einem Substratatom). Schließlich darf auch nicht vergessen werden, daß es sich im praktisch-experimentellen Fall um eine "reale" Oberfläche handelt, die durch das Auftreten von Defekten gekennzeichnet ist. Es ergeben sich hieraus eine Vielzahl von weiteren z. T. hoch koordinierten Adsorptionsplätzen, z. B. an Stufen und Kinken, an Fremdatomen oder Vakanzen.
Die verwendete Re(0001)-Fläche hat eine Oberflächendichte von 1,52 x 1015 cm-2 und eine atomare Korrugation entlang der dicht gepackten Atomreihen von etwa 0,1 Å [Par96/d].