![]()
![]()
![]()
![]()
![]()
Teil I - Theoretische Grundlagen
1. Das Meßsystem
1.1 Die Metalle Rhenium und Kupfer
1.1.1 Allgemeines
a) Kupfer
Kupfer ist eines der ältesten bekannten Metalle. Die Verwendung von Kupfer läßt sich bis zum Ausgang der Steinzeit (5000 Jahre v.u.Z.) verfolgen. Bereits im dritten Jahrhundert v.u.Z. gab es Bronzeschmelzstätten in Ägypten und Mitteleuropa.
Kupfer ist am Aufbau der Erdkruste (bis 16km Tiefe) zu 0.004% beteiligt. Die wichtigsten Kupfererze sind Kupferkies (Chalkopyrit) CuFeS2, Buntkupferkies (Bornit) CuFeS4 und Kupferglanz (Chalkosin) Cu2S. Weitere nicht sulfidische Erze sind Rotkupfererz (Cuprit), Malachit und Kupferlasur (Azurit).
Verwendung findet das Kupfer auf Grund seiner hervorragenden Eigenschaften (in seiner Fähigkeit Wärme und den elektrischen Strom zu leiten wird es nur vom Silber übertroffen) als Leitungsmaterial in der Elektrotechnik und im Apparatebau. Auch bei der Herstellung von Legierungen kommt Kupfer zur Anwendung. Bronzen (Cu-Sn), Messing / Rotguß (Cu-Zn) und Neusilber (Cu-Ni-Zn) sind als Legierungen des Kupfers sehr bekannt.
In der Chemie kommt Kupfer auf Grund seiner Fähigkeit, Redoxreaktionen, vor allem mit Luftsauerstoff, zu beschleunigen, in reiner sowie in Form seiner Verbindungen zur Anwendung.
Kupfer ist ein rötliches, nicht sehr hartes aber sehr dehnbares Metall. Im Periodensystem der Elemente befindet es sich in der 11. Gruppe (erste Nebengr.) und vierten Periode. Seine Kernladungszahl beträgt 29. Es kommt in Form seiner Isotope 63Cu zu 69% und 65Cu zu 31% vor. Seine Elektronenkonfiguration ist [Ar]3d104s1 (2S-Term), seine Oxidationszahlen sind +1, +2, +3.
b) Rhenium
Erstmals wurde Rhenium nach gezielter Suche 1925 von Noddak und Tacke röntgenographisch nachgewiesen.
Es ist ein sehr seltenes Element. Am Aufbau der Erdkruste ist es zu 0.001 ppm beteiligt.
Das Rhenium kommt nur zusammen mit anderen Elementen vor. Man findet es etwas angereichert im Molybdänglanz (0,0001% bis 0,001%), im Columbit, Gadolinit, Tantalit und in Platinerzen. In den Abfallprodukten der Kupferverhüttung kommt es zu 0,005% vor.
Aus Rhenium werden Glühdrähte (Filamente) und Thermoelemente hergestellt. Außerdem kommt es als Legierungsmetall und Komplexbildner / Katalysator in Betracht. Es besitzt nach Wolfram die höchste Schmelztemperatur aller Metalle (s. Tab.1).
Rhenium ist ein in seinem Aussehen dem Platin ähnliches, sehr hartes Metall. Seine Stellung im Periodensystem der Elemente ist die siebte Gruppe und sechste Periode, seine Kernladungszahl ist 75. Es besteht zu 63% aus dem schwach radioaktiven Isotop 187Re und zu 37% aus dem stabilen Isotop 185Re. Seine Elektronenstruktur ist [Xe]4f145d56s2 (6S-Term), es kann in allen Oxidationszahlen von -1 bis +7 auftreten.
1.1.2 Thermodynamische Daten
Die wichtigsten thermodynamischen Daten sind in Tabelle 1 dargestellt. Sie wurden der Arbeit von Weast [WEA72] entnommen, außer a) [NET01], b) [NET02], c) [BAU87], d)[ROD92].
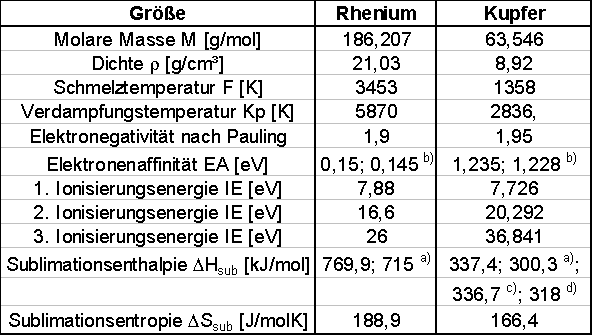
Tabelle 1
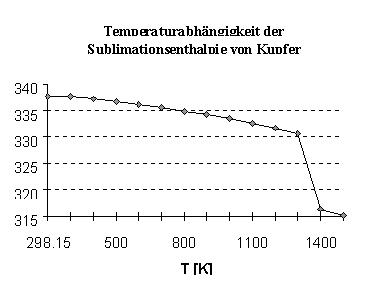
Abbildung 1 Sublimationsenhalpie in Abhängigkeit von der
Temperatur nach Werten aus [WEA72]
Die Sublimationsenthalpien beziehen sich auf die Standardbedingungen. Für andere Temperaturen ergibt sie sich aus Abb.1.
1.1.3 Kristallographische Daten
Kupfer kristallisiert in der kubisch-dichtesten Kugelpackung (fcc), Rhenium hingegen in der hexagonal-dichtesten Kugelpackung (hcp). Tabelle 2 [WEA74] enthält die kristallographischen Parameter.

Tabelle 2
Es ergibt sich ein Mißverhältnis der Gitterkonstanten (Misfit) von 7,6% zugunsten von Rhenium.
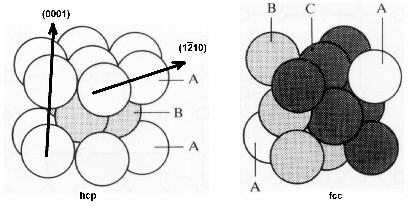
Abbildung 2 Gittersrukturen des Rheniums und des Kupfers [SHR92]
In Abb.2 ist das hcp-Gitter des Rheniums sowie das fcc-Gitter des Kupfers
abgebildet (nach [SHR92]). In der (1![]() )-Richtung
befinden sich die Atome in dichtgepackten Reihen mit der Gitterkonstante
a1, in der (0001)-Richtung besitzen die Schichten einen größeren
Abstand a2. Durch die Buchstabengruppen (ABA) bzw. (ABC) und
die verschiedene Schwärzung wird die unterschiedliche Stapelfolge
verdeutlicht.
)-Richtung
befinden sich die Atome in dichtgepackten Reihen mit der Gitterkonstante
a1, in der (0001)-Richtung besitzen die Schichten einen größeren
Abstand a2. Durch die Buchstabengruppen (ABA) bzw. (ABC) und
die verschiedene Schwärzung wird die unterschiedliche Stapelfolge
verdeutlicht.
1.1.4 Das System Kupfer-Rhenium
Ausgeprägte Mischphasen aus Kupfer und Rhenium existieren nicht [HOL54]. Die maximale Löslichkeit von Rhenium in Kupfer ist 1 bis 2ppm [HEN69].
Wie stark die Wechselwirkungen von Kupfer mit Rhenium sind, läßt sich durch einige allgemeine Betrachtungen grob abschätzen. Kupferatome besitzen ein halb besetztes 4s-Orbital. Im Rheniumkristall ist das 5d-Valenzband ebenfalls halb gefüllt (vgl. 1.1.1). Beide Elemente sind also relativ elektronenarm, und es ergeben sich nur kleine elektronische Wechselwirkungen. Ein Elektronenfluß zur Angleichung der Fermi-Niveaus (Charge-Transfer) sollte klein sein. Die Elektronegativitäten nach Pauling unterscheiden sich ebenfalls kaum. Rodriguez [ROD92] fand in XPS-Untersuchungen fast gleiche Bindungsenergien der 2p3/2-Elektronen des Kupfers auf der Re(0001)-Oberfläche und auf der Oberfläche von reinem Kupfer(111). Im Kohlenmonoxid-Thermodesorptionsspektrum (CO-TDS) findet sich eine Verschiebung des Desorptions-maximums zwischen reinem Kupfer und Cu/Re von nur +25K. Diese Ergebnisse deuten ebenfalls auf ähnliche Elektronendichten hin. Es sollten sich auf der Rheniumoberfläche hauptsächlich kovalente Bindungen ausbilden.
1.2 Die Re(0001)-Oberfläche
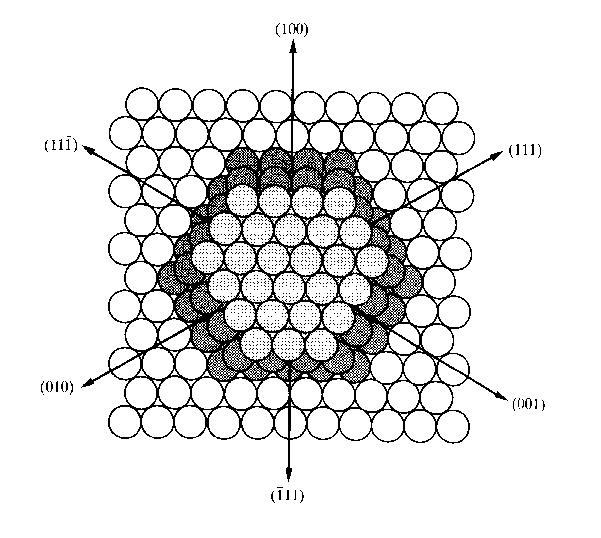
Abbildung 3 Die hcp (0001) (bzw. fcc (111))-
Oberfläche [SHR92]
Die (0001)-Oberfläche ist durch die dicht gepackte Anordnung der Atome bestimmt. Sie zeichnet sich durch eine sechszählige Symmetrie aus. Damit liegt eine sehr geschlossene Fläche mit drei verschiedenen Hauptadsorptionsplätzen vor, nämlich einfach (genau auf einem Oberflächenatom), zweifach (zwischen zwei Atomen) oder dreifach (zwischen drei Atomen) koordinierte.
Es ergibt sich eine Oberflächenatomdichte von r2D=1,52x1015cm-2. Eine Draufsicht zeigt Abbildung 3 [SHR92]. Die atomare Korrugation entlang der dicht gepackten Reihen von Atomen beträgt etwa 0,1Å [PAR96].